Leerwerk deel 8
Instrumentele analyse
Kwalitatieve analyse= Wat zit er in?
Kwantitatieve analyse= Hoeveel zit er in?
Titratie
Zuur-base bijvoorbeeld natronloog met zoutzuur
H3O+ + OH- -> 2H2O
Bij het eindpunt geldt hoeveelheid H3O+ = hoeveelheid OH-
Redox:
Een aangezuurde kaliumpermanganaat oplossing met oxaalzuur
H2C2O4 -> 2CO2 + 2 H+ + 2e
MnO4- + 8H+ +5e -> Mn2+ + 4H2O
5H2C2O4 + 2MnO4- + 6H+ -> 10CO2 +2 Mn2+ + 8H2O
Bij het eindpunt geldt:
hoeveelheid MnO4- : H2C2O4 = 2 : 5
Een natriumthiosulfaatoplossing met jood
I2 + 2e -> 2 I-
2 S2O32- -> S4O62- + 2e
I2 + 2 S2O32- -> 2 I- + S4O62-
Bij het eindpunt geldt:
hoeveelheid I2 : hoeveelheid S2O32- = als 1 : 2
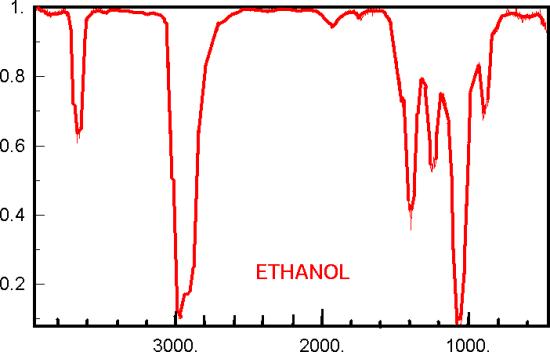
IR-absorptiespectra
Gebruik tabel 39b uit Binas
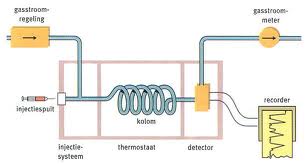
Chromatografie
De opstelling
Het chromatogram
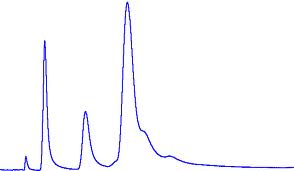
De tijd tussen de tijd dat je de stof injecteert en er een piek verschijnt is
de retentietijd.
De oppervlakte van de piek is een maat voor de hoeveelheid van de stof.
Colorimetrie
Begrippen:
T=Transmissie ( wat door wordt gelaten)
E=Extinctie ( de uitdoving)
I=Intensiteit van het licht
T=I/I0 Met I0 wordt bedoeld dat alle licht door de cuvet gaat.
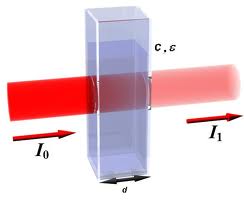
E=log(I0/I)
E=e.c.d met
e=extinctiecoefficient
c=concentratie
d=weglengte van de cuvet
Oefening
Massaspectrometrie

De pieken komen van Br twee isotopen
en van Br2
In Binas vind je twee isotopen:(Table 25a)
Br met massagetal 79 en Br met massagetal 81
dus:
piek 1 = Br-79
piek 2 = Br-81
piek 3 = Br2 opgebouwd uit Br-79 - Br-79
piek 4 = Br2 opgebouwd uit Br-79 - Br-81
piek 5 = Br2 opgebouwd uit Br-81 - Br-81
Oefening




